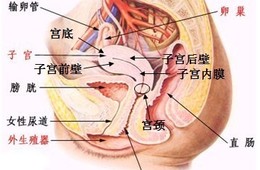
子宫腺肌病导致的继发性痛经可能与痛觉敏化有关,当致痛因子作用于神经之后,痛觉感受器数量或神经纤维密度会显著增加,从而导致痛觉过敏。同时致痛因子还通过提高初级传入神经的兴奋性,改变离子通道和产生神经递质,增强中枢神经敏感性,导致痛经程度加剧。
1.神经生长因子(NGF)参与调控疼痛
NGF最早被发现是一类由神经支配的靶器官分泌并被神经末梢摄取和转运,在疼痛过程中起到关键调节作用的神经营养因子,目前NGF调控子宫腺肌病疼痛的分子机制仍不清楚,但却肯定与以下机制有关:①NGF通过作用NGF的受体Trk-A和P75,导致子宫肌层病灶的神经纤维过度生长。②NGF本身是一种疼痛介质,可以诱导中枢疼痛传递过程中有关P物质(SP)、降钙素基因相关肽(CGRP)和神经因子(NF)的表达。相关研究中发现,子宫腺肌病患者病灶中NGF异常升高,并与痛经的严重程度显著相关,可以推测NGF参与子宫腺肌病疼痛的发生与发展。
2.瞬时受体电位超家族辣椒素亚型1(TRPV1)参与调控疼痛
子宫内膜的功能层主要由无髓感觉神经纤维C支配,可被子宫内膜释放的炎症介质启动或致敏,导致神经源性炎症。TRPV1主要分布于对辣椒素类物质敏感的感觉神经纤维C和少量的Aδ纤维上,调控机制如下:①TRPV1通过蛋白激酶A和蛋白激酶C介导,使前列腺素(PG)与前列腺素受体(PGR)增加导致TRPV1对疼痛的敏感性增强。②TRPV1被炎性因子启动后,可以调节神经细胞内外的Ca2+浓度差造成细胞去极化,并同时伴随SP、CGRP等物质释放,增强疼痛反应。
3.SP、CGRP参与调控疼痛
SP、CGRP是由无髓感觉神经纤维C分泌的神经肽,它们在疼痛传递过程中发挥着重要作用。研究发现,子宫腺肌病患者的子宫内膜、肌层无髓感觉神经纤维C数量和密度均显著增加。调控机制如下:①无髓感觉神经纤维C分泌SP、CGRP,导致病灶周围感觉神经敏化,疼痛阈值相对降低。②SP、CGRP改变血管通透性,促进血管运输的炎性因子在病灶周围释放,加剧炎性疼痛反应。③SP、CGRP与5-羟色胺等炎性因子协同作用,共同参与了子宫内膜、肌层病灶的神经敏化过程。
4.缓激肽(BK)参与调控疼痛
BK作为人体内最强的内源性致痛因子,主要由机体损伤部位的酶降解血浆蛋白形成,子宫腺肌病患者病灶组织中的BK受体显著增加,且BK受体的mRNA表达水平与痛经呈正相关。调控机制如下:①BK的受体属于与磷酸酯连接的G蛋白偶联受体,可以介导包括
BK、PG在内的激素表达水平,增强机体的痛觉效应。②BK直接参与病灶周围神经的敏化过程,降低伤害性感受器疼痛阈值,造成痛觉过敏。③子宫腺肌病内膜和肌层异位病灶周期性出血,其血浆中的血红蛋白被降解释放更多的BK,由此加重局部的炎性反应,造成痛经加重现象。
参考文献:王波,吴明富.子宫腺肌病导致继发性痛经相关机制的研究进展[J].华中科技大学学报(医学版),2019,48(01):119-122.
多种致痛因子参与子宫腺肌病继发性痛经患者痛觉敏感调节机制

-
十七
2020-02-17 16:22:33
317200
疾病咨询专业医生为您解答疑问
推荐阅读
其他文章